Dua jenis ikatan adalah ikatan ionik dan ikatan kovalen. Sifat senyawa kovalen antara lain.

Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen
X 2 Y 2 E.

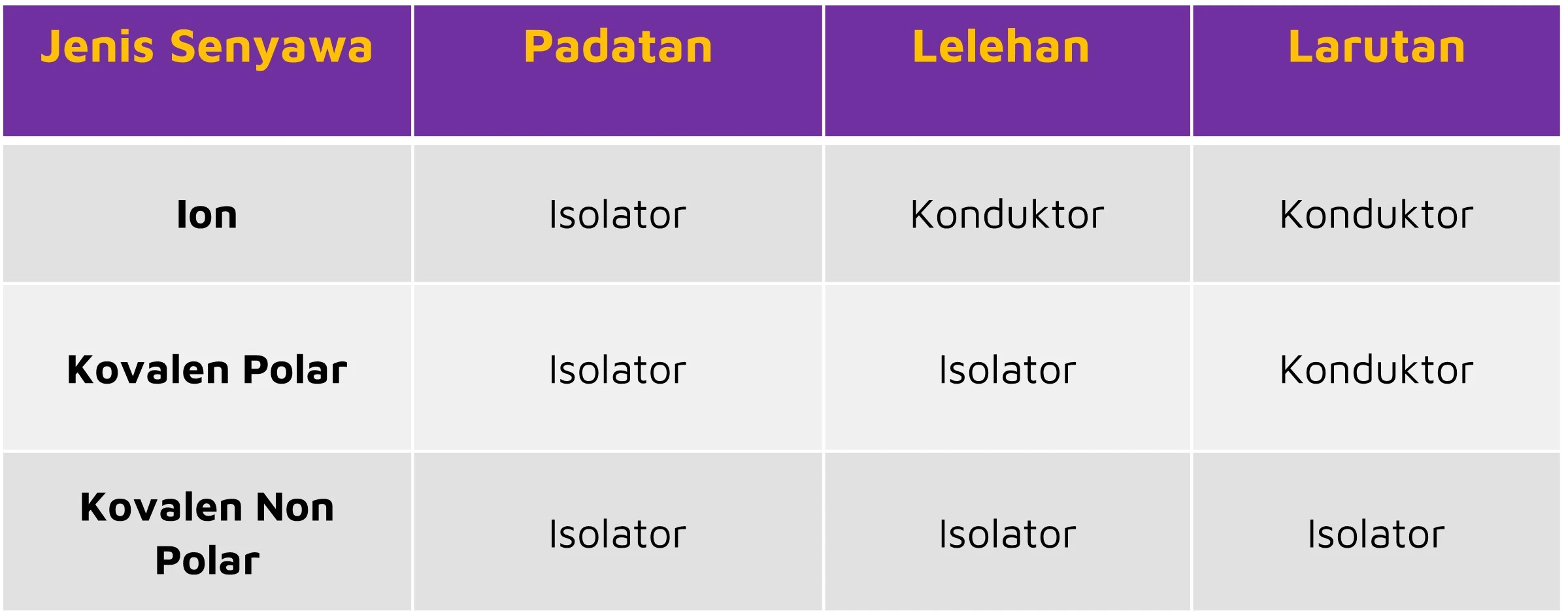
. X 2 Y 3 UN 2008 2. Untuk mempermudah kalian mengingat dan memahaminya kalian bisa tabel dibawah ini perbedaan elektrolit pada senyawa ion kovalen polar dan kovalen non polar. Lelehan wujud ini dapat menghantarkan listrik karena dalam bentuk lelehan ion-ionnya bergerak relatif bebas.
Perbedaan Senyawa Ion Dan Kovalen Polar Beberapa senyawa kovalen polar jika dilarutkan ke dalam air dapat mengalami ionisasi. Jika 12 X 24 dan 17 Y 355 berikatan maka rumus senyawa yang dihasilkan adalah. HF asam florida.
HCl adalah senyawa kovalen polar yang artinya memiliki sifat-sifat sebagai. Untuk memahami perbedaan wujud senyawa ionik dan kovalen polar ini berikut penjelasannya. Perbedaan Senyawa Ion Dan Kovalen.
Memiliki titik didih dan titik leleh yang tinggi 2. Senyawa kovalen polar hanya dapat menghantarkan listrik dalam larutan dan senyawa kovalen nonpolar tidak dapat menghantarkan listrik. Dalam bentuk padatan atau lelehan senyawa kovalen tidak.
Terlihat kuat tapi sebenarnya rapuh dan hancur jika dipukul. Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik. Titik didih dan titik leleh.
X 2 Y D. Senyawa kovalen yaitu senyawa yang terdiri dari atom-atom yang diberikatan secara kovalen. Larutan ini dalam air terionisasi sebagian.
Perbedaan Kunci - Senyawa Ionic vs Kovalen. Perbedaan antara senyawa ionik dan kovalen dapat membingungkan. Contoh larutan yang termasuk dalam senyawa kovalen polar adalah larutan HCl atau yang biasa disebut larutan asam klorida.
Meski demikian senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik. Senyawa kovalen ada senyawa kovalen polar dan nonpolar. Ikatan ionik adalah ikatan yang dihasilkan dari perpindahan elektron dari satu atom ke atom lain.
Ciri-ciri senyawa kovalen 1. Pada suhu kamar berbentuk padat B. Titik leleh rendah kemungkinan adalah senyawa B atau D Tidak menghantarkan listrik dalam bentuk lelehan tetapi menghantarkan listrik dalam bentuk larutan karena senyawa kovalen polar dapat larut dan mengion di dalam air.
Sobat materikimia sma pasti sudah memahami bahwa ikatan ion dan ikatan kovalen berbeda dalam proses pembentukannya. Berikut ini data sifat fisik dua buah zat. Senyawa kovalen berwujud lunak dan tidak mudah rapuh.
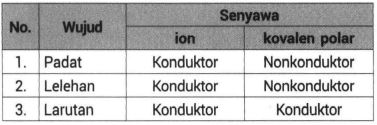
Senyawa kovalen tidak dapat menghantarkan listrik. Senyawa kovalen polar hanya dapat menghantarkan listrik dalam larutan dan senyawa kovalen nonpolar tidak dapat menghantarkan listrik. Lelehan dan larutannya dapat menghantarkan arus listrik 4.
Oleh sebab itu larutan yang bersumber dari senyawa ionik dapat menghantarkan arus listrik dengan baik dan termasuk ke dalam larutan elektrolit kuat. Padatan wujud ini tidak dapat menghantarkan listrik karena dalam bentuk padatan tidak ada ion yang bergerak secara bebas. Senyawa kovalen memiliki titik didih dan titik leleh yang rendah.
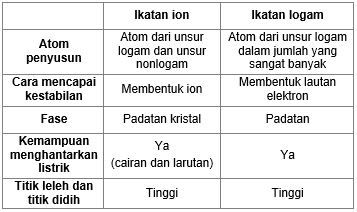
Untuk senyawa ion ikatan ion yaitu senyawa yang terbentuk dari logam dan non logam yang berikatan ion. Perbandingan senyawa ion dan kovalen. Karena mereka tidak mengandung ion.
Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka. Pada suhu kamar berbentuk gas ada juga yang berwujud cair dan padat. Larutan elektrolit bersifat menghantarkan arus listrik yang disebabkan oleh adanya ion positif dan negative dalam larutan.
Ciri-ciri senyawa ion 1. Senyawa kovalen memiliki ikatan kovalen. Memiliki titik didih dan titik leleh yang relatif rendah.
Daya Hantar Senyawa Kovalen Polar. Sehingga kebanyakan senyawa kovalen ialah nonelektrolit. Satu atom memberikan satu atau lebih dari elektron.
No Zat Q Zat R 1 Titik didih tinggi Titik leleh rendah 2 Daya hantar listrik besar. Mudah larut dalam air 3. Perbedaan senyawa ion dan senyawa kovalen.
Senyawa ionik membantu untuk menghantarkan listrik dalam air karena mereka membawa muatan. Senyawa ion juga lebih larut. Senyawa ionik adalah senyawa yang atom-atomnya berikatan secara ionik.
Namun dalam bentuk larutan suatu elektrolit baik atau buruknya menghantarkan listrik pada senyawa kovalen polar dalam wujud larutannya tergantung dari perbedaan elektronegativitas antara atom dalam senyawa kovalen polar tersebut jadi bisa baikburuk dalam menghantarkan listrik. Senyawa ion memiliki ikatan ion dalam bentuk lelehan dan larutan dapat terionisasi sempurna menghasilkan ion-ion yang dapat bergerak bebas. Mereka juga memiliki sifatnya sendiri sehingga bisa menjadi pembeda.
Definisi dasar dari suatu senyawa ionik adalah bahwa mereka adalah molekul yang terdiri dari ion bermuatan. Senyawa kovalen polar hanya dapat menjadi konduktor yang baik jika dilarutkan dengan menggunakan zat pelarut yang tepat. Sifat-sifat senyawa kovalen adalah.
Padatan wujud ini tidak dapat. Senyawa kovalen terdiri dari molekul-molekul bersifat netral dan tidak sanggup menghantarkan listrik. Ion dapat menghantarkan arus listrik sedangkan senyawa kovalen tidak dapat menghantarkan arus listrik months agoKomentar 6805Dibaca Share LikeTop ListListElektrolit dan NonelektrolitBerdasarkan sifat daya hantar listriknya larutan dibedakan menjadi dua yaitu larutan elektrolit dan nonelektrolit.
Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih. Perbedaan sifat fisik senyawa ion kovalen dan logam. Zat terlarut pada larutan elektrolit dapat terionisasi sempurna dan menghasilkan ion dalam jumlah maksimum zat terlarut ini dinamakan elektrolit kuat.
Oleh karena itu pola ikatan mereka dapat. Larutan elektrolit dapat dibuat dari senyawa ion dan kovalen. Senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik.
Dalam bentuk padatan solid senyawa ion tidak dapat menghantarkan arus listrik karena ion ionnya tidak dapat bergerak bebas. Meski demikian senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik. Sedangkan dalam bentuk lelehan liquid dapat menghantarkan listrik karena ion ion nya dapat bergerak bebas.

Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id

Top 10 Jelaskan Perbedaan Daya Hantar Listrik Dari Senyawa Ion Dan Senyawa Kovalen Yang Berupa Padatan 2022
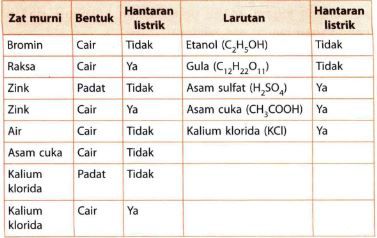
Tabel Berikut Merupakan Hasil Pengujian Daya Hanta

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube
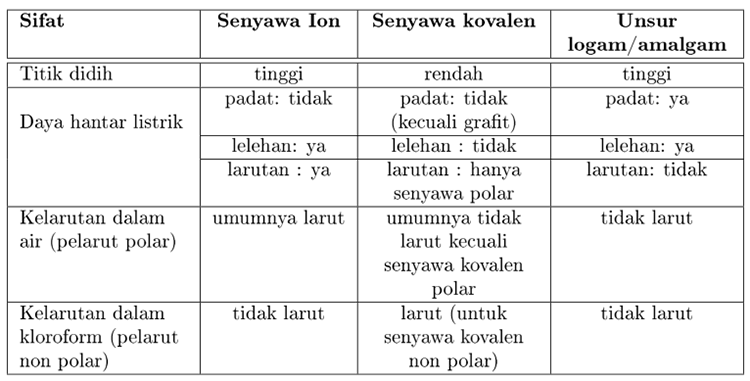
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Perbedaan Senyawa Ion Senyawa Kovalen Dan Lo Utakatikotak Com

Pengertian Sifat Dan Contoh Dari Senyawa Ion Panduan Kimia Riset

Mengapa Lelehan Senyawa Kovalen Polar Tidak Dapat Menghantarkan Listrik Sedangkan Lelehan Ion Dapat Menghantarkan Listrik

Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Mengapa Leburan Senyawa Ion Dapat Menghantarkan Listrik Sedangkan Senyawa Ion
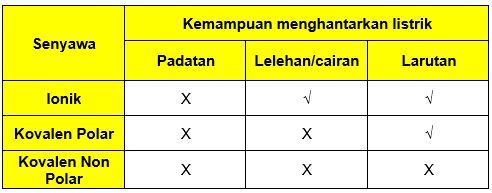
Perhatikan Beberapa Zat Berikut Asam Klorida

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection
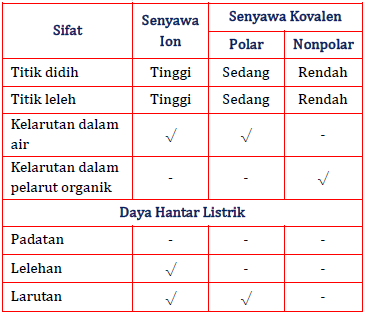
Diketahui Data Fisik Dua Buah Senyawa Sebagai Beri
Persamaan Ionisasi Senyawa Elektrolit Dalam Air Berikut Yang Benar Adalah Duuwi Com
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection
Lakukan Analisis Apakah Perbedaan Dan Persamaan Da
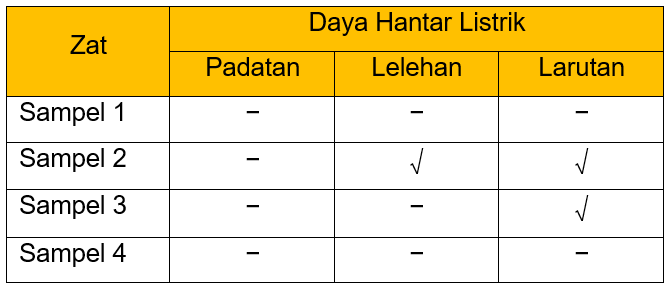
Disajikan Data Hasil Pengujian Daya Hantar Listrik
